沈陽藥科大學國際食品藥品政策與法律研究中心
質(zhì)量風險管理(QRM)領域的工作人員應該熟悉制藥和生物制藥產(chǎn)品風險管理的歷史以及風險管理作為監(jiān)管工具的作用。
本文回顧了藥品風險管理的起源和將QRM作為制藥研發(fā)和生產(chǎn)領域中一門獨特學科的監(jiān)管理念。
早期的藥品風險管理
自相關監(jiān)管機構(gòu)成立以來,風險管理一直是醫(yī)療保健產(chǎn)品監(jiān)管的基本內(nèi)容;確實,有人可能會認為,這種監(jiān)管機構(gòu)存在的目的就是為了保護公眾,使其免受與藥品使用相關的健康及安全風險。
有來源的早期處方集(可視為藥典)可追溯到公元1世紀的希臘文本記錄(如普林尼博物志中提到的草藥目錄)[1]。1240年由西西里島弗雷德里克二世頒布的《薩勒諾醫(yī)療法令》(Salerno Medical Edict)是已知的類似于藥典的最早法規(guī), 該法規(guī)要求藥劑師要以統(tǒng)一的方式準備藥物[2]。在中世紀,這些法規(guī)在整個歐洲大陸得到普及,人們逐漸認識到保證藥物制劑之間的一致性對于確保藥品療效的必要性,能夠最大限度地降低患者風險。
19世紀后期,有關藥物的更多法律生效實施。1846-1848年美國與墨西哥戰(zhàn)爭之后,美國頒布了與藥品相關的第一部法律。美墨戰(zhàn)爭中,美國士兵接受了各種藥物治療(治療疾病包括瘧疾、黃熱病和霍亂)。這其中許多藥物都是進口的,但是部分藥品卻缺少安全性和有效性,無法滿足軍隊需求。在這一時期出現(xiàn)的大量死亡事件,不僅歸因于戰(zhàn)爭,還歸因于使用了這些缺陷性藥品。1848年美國通過了《藥品進口法》(Import Drug Act),以確保進口藥物在入境之前進行純度和質(zhì)量檢測。[3]
美國擁有世界上最大的藥品消費群體,幾大藥品慘案促進了FDA管理范圍擴大和法規(guī)的發(fā)展。圖1顯示了美國藥品相關法律的早期發(fā)展歷程。[2,3,4,5]
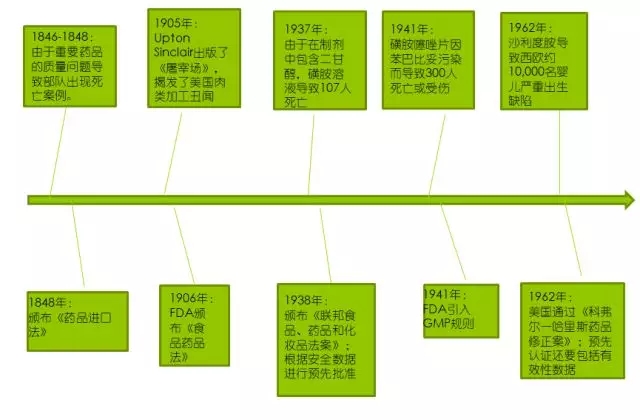
圖1 美國藥品相關法律的早期發(fā)展歷程
這種風險反應模式(pattern of reactivity)一直持續(xù)到今天。在這種模式中,醫(yī)療災難事件(healthcare disaster)是監(jiān)管科學取得進展的前提。例如,2008年的肝素鈉事件致多人死亡,之后人們對原料藥(active pharmaceutical ingredients ,API)的管理和供應鏈的控制越發(fā)關注。[6,7]雖然這種風險反應模式有助于預防類似的傷害與死亡事件再次發(fā)生,但令人唏噓的是,使用正確的工具與正確的理念本可以避免這類悲劇的發(fā)生。
預防原則
預防原則是最早進入到公共領域的前瞻性風險管理思想體系的原則之一。該原則最初是在《環(huán)境法》的背景下提出的,該原則認為,在面臨給定風險的不確定性時,特別是當風險會引起嚴重和持續(xù)的后果時,必須足夠謹慎,才能為社會提供所需的保護。[8,9]該原則作為監(jiān)管機構(gòu)的決策指南,是在缺乏關于某種風險的科學證據(jù)的情況下被引入的。在這些情況下,未主動避免風險可能會導致極大的人員和成本損失;因此,唯一正確的反應是采取適當措施(如禁止使用某種物質(zhì))來保護公眾,同時增加對風險的認識。[8,9]作為決策輔助工具,預防原則可以被看作是一個基本的風險管理過程,如圖2所示。[8,9,10]
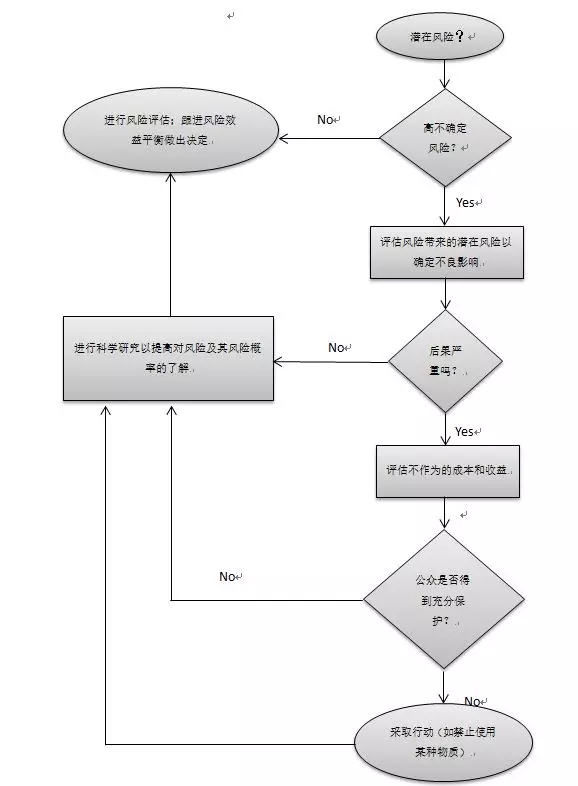
圖2 預防原則應用決策樹
預防原則的前瞻性源于對不確定性來源的早期識別,并進行協(xié)同合作,以避免相關風險,直到不確定性減少或被消除。這樣以來,風險的概念就與科學知識聯(lián)系在一起,因此只有對得出的結(jié)論充分理解才能有效地實施合適的風險管理。
風險管理在現(xiàn)代藥品監(jiān)管中的作用
藥品和生物制品風險管理的現(xiàn)代探索源于1999年風險管理工作小組(the Task Force on Risk Management)提交的報告。該工作小組由時任專員Jane Henney博士組建,其任務是確定當時FDA內(nèi)部正在進行的風險管理活動的技術(shù)合理性、一致性與有效性,并給出建議以提高這些活動的效果和效率。小組最終報告《管理醫(yī)療產(chǎn)品使用風險:創(chuàng)建風險管理框架》(Managing the Risks from Medical Product Use: Creating a Risk Management Framework)中,重點關注新藥申請(new drug applications ,NDAs)、生物制品許可申請( biological license applications,BLAs)以及醫(yī)療器械的上市前批準(premarket approvals ,PMAs)的上市前風險效益評估(premarket benefit-risk assessments)以及上市后監(jiān)管活動。[11]該報告并沒有探討與質(zhì)量相關的風險管理,其解釋說:“在生產(chǎn)過程中,由于對產(chǎn)品質(zhì)量控制和質(zhì)量保證給予了高度重視,因此,因產(chǎn)品缺陷所造成的傷害事件在美國并不常見。”[11] 雖然有這個聲明,報告仍舊根據(jù)當時對產(chǎn)品質(zhì)量的理解,對一些由于缺乏QRM而造成傷害與死亡的案例進行了研究。
某案例中,藥品包裝混淆致使醫(yī)院誤用藥物,導致3人受傷、1人死亡。分銷商Burroughs Wellcome以相似的包裝方法對涉案產(chǎn)品與其它產(chǎn)品進行包裝(包裝的透明窗口內(nèi)夾有產(chǎn)品標簽)。這種包裝設計會導致產(chǎn)品標簽在包裝的透明窗口內(nèi)移動,從而使產(chǎn)品標簽滑動到窗口下方,相關人員無法看到標簽,因此難以確定包裝內(nèi)容物。因此,錯誤的藥品在不知情的情況下被患者服用是造成傷害與死亡的根源。[11] 該報告并沒有解釋應用QRM能夠提前預估并避免這種包裝設計帶來的使用錯誤。
盡管報告涉及的范圍可能有限,但仍提出了若干建議,以改善風險溝通并在發(fā)現(xiàn)潛在風險時進行早期干預。這些建議最終幫助FDA成功實施了幾項計劃,如建立風險評估和減低策略(risk evaluation and mitigation strategies,REMS)以及前哨不良事件追蹤系統(tǒng)(Sentinel adverse event tracking system),改善數(shù)據(jù)收集和風險管理,從而更好地保護公共健康。
盡管1999年的報告標志著監(jiān)管當局對風險管理和風險決策的存在和有效性進行了現(xiàn)代以來的首次調(diào)查,但質(zhì)量風險管理的問題卻未得到解決。
2002年8月,F(xiàn)DA提出一個成熟的前瞻性風險管理概念(包括內(nèi)部和外部的風險管理),同時頒布了《21世紀藥品cGMP——基于風險的方法》。該計劃的目標如下:
?鼓勵制藥行業(yè)盡早采用新的先進技術(shù)
?促進現(xiàn)代質(zhì)量管理技術(shù)在藥品生產(chǎn)和質(zhì)量保證等各個方面的應用,包括實施質(zhì)量體系方法
?鼓勵對制藥行業(yè)及FDA所關注的關鍵領域?qū)嵤┗陲L險的方法
?確保監(jiān)管審查、合規(guī)和檢查政策是基于最先進的制藥科學
?加強FDA藥品質(zhì)量監(jiān)管計劃的一致性和協(xié)調(diào)性,在某種程度上,能夠?qū)①|(zhì)量體系方法進一步納入FDA審查和檢查活動的流程和監(jiān)管政策中。
2004年9月發(fā)布的關于該計劃的最終報告闡述了FDA為完成或鼓勵實施以上目標制定的政策框架。盡管這些目標中,只有一個目標將風險管理列為重點領域,但仔細閱讀最終報告就會發(fā)現(xiàn)風險原則是該計劃的基礎。
根據(jù)該報告,行業(yè)和FDA將建立質(zhì)量體系模式進行質(zhì)量管理與監(jiān)管。盡管質(zhì)量體系概念在醫(yī)療器械監(jiān)管中已經(jīng)實施了一段時間(例如, ISO 13485中的醫(yī)療器械質(zhì)量管理體系——管理目的、21 CFR 820中的質(zhì)量體系要求),但在制藥和生物制藥領域內(nèi)這種質(zhì)量風險管理還是較為先進的理念。
在《21世紀藥品cGMP》計劃的框架下,F(xiàn)DA在監(jiān)管科學方面已經(jīng)取得了若干進展,這些進展將最先進的科學技術(shù)知識與基于風險的理念相結(jié)合。 包括:
?為檢查監(jiān)督創(chuàng)建基于風險的模型
?發(fā)布關于21 CFR第11部分《電子記錄,電子簽名的新指南》,鼓勵使用基于風險的方法
?發(fā)布無菌操作的新指南——《無菌操作生產(chǎn)的無菌藥品的cGMP》,強調(diào)在無菌產(chǎn)品生產(chǎn)過程中應主動避免污染,并進一步鼓勵采用確保無菌的風險管理原則。[12]
《21世紀藥品cGMP》計劃標志著藥品監(jiān)管的模式轉(zhuǎn)變:從基于規(guī)則的合規(guī)(其中重點在于遵循法規(guī),通常以犧牲對產(chǎn)品、工藝和相關風險的深刻理解為代價)轉(zhuǎn)向基于風險的質(zhì)量和合規(guī)。在該研究背景下,該計劃最終報告中最值得關注的重點可能是重復使用有效風險管理這個短語。有效風險管理的含義是:風險管理如果執(zhí)行不當,可能會導致效率低下。這是一個相當奇怪的現(xiàn)象,因為基于風險的框架被應用于某個特定問題的原因之一是要確保資源有效地分配。因此,應以高效、有效的方式進行風險管理,以便給患者帶來高效、有效的治療效果。雖然行業(yè)渴望理解質(zhì)量風險管理的理念,但就目前來講,行業(yè)對該理念的理解仍不充分。
參考文獻
1.van Tellingen, C. Pliny's pharmacopoeia or the Roman treat. Netherlands Heart Journal, 15 (3). Mar 2007.
2.Rago, L. and Santoso, B. Drug Regulation: History, Present and Future. [ed.] C.J. van Boxtel, B. Santoso and I.R. Edwards. Drug Benefits and Risks: International Textbook of Clinical Pharmacology, 2nd edition. s.l. : IOS Press, 2008.
3.Ranhalker, H. Historical Overview of Pharmaceutical Industry and Drug Regulatory Affairs. Pharmaceutical Regulatory Affairs. S11-002, 2012.
4.FDA. A History of the FDA and Drug Regulation in the United States. [Online] [Cited: Aug 20, 2016.] http://www.fda.gov/centennial/history/history.html.
5.Wilkins Parker, J. Risk Management in the United States. [Online] [Cited: Aug 20, 2016.] http://www.fda.gov/downloads/Drugs/ResourcesForYou/HealthProfessionals/UCM473163.pdf.
6.Greenemeier, L. Heparin Scare: Deaths from Tainted Blood-Thinner Spur Race for Safe Replacement. Scientific American. [Online] Nov 4, 2008. [Cited: Aug 20, 2016.] http://www.scientificamerican.com/article/heparin-scare-deaths/.
7.Pew Health Group. After Heparin: Protecting Consumers from the Risks of Substandard and Counterfeit Drugs. 2011.
8.EC. COM(2000) 1. On the precautionary principle. Feb 2000.
9.WHO. The precautionary principle: protecting public health, the environment, and the future of our children. 2004.
10.United Nations Education, Science, and Cultural Organization (UNESCO), World Commission on the Ethics of Scientific Knowledge and Technology. The Precautionary Principle. Mar 2005.
11.FDA. Managing the Risks from Medical Product Use: Creating a Risk Management Framework. May 1999.
12.FDA. Pharmaceutical cGMPs for the 21st Century — A Risk Based Approach. Final Report. Sep 2004.
文章來源:
https://www.bioprocessonline.com/doc/quality-risk-management-a-brief-history-of-risk-management-in-the-regulation-of-medicinal-products-0001